美國費城兒童醫(yī)院: 刺激肺組織修復(fù)的新靶點
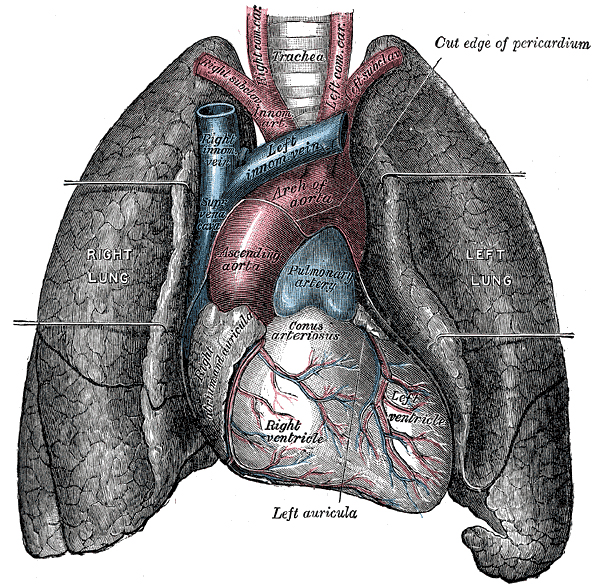
人體胸腔內(nèi)的心臟與肺部,以及大血管。圖片來源:Wikipedia
美國費城兒童醫(yī)院(CHOP)和賓夕法尼亞大學(xué)佩雷爾曼醫(yī)學(xué)院的研究結(jié)果發(fā)表在《自然·細(xì)胞生物學(xué)》(Nature Cell Biology)雜志上。該研究為肺部疾病患者提供了更好的治療方法,其中包括由COVID-19引起急性呼吸窘迫綜合征(ARDS)的患者。
資深作者G. Scott Worthen博士說:“我們利用全基因組和單細(xì)胞分析等前沿技術(shù),鑒定了一條參與肺組織再生特定的細(xì)胞信號通路,并找到一種能促進(jìn)再生過程的藥物。這些發(fā)現(xiàn)提供了精確的靶標(biāo),從而允許合理開發(fā)干預(yù)措施以治療COVID-19和其他疾病引起的肺部疾病?!盙. Scott Worthen醫(yī)學(xué)博士是CHOP新生兒科的臨床科學(xué)家,也是Penn-CHOP肺部生物學(xué)研究所(Penn-CHOP Lung Biology Institute)的成員。
肺炎、流感和ARDS(COVID-19已知的并發(fā)癥之一)等疾病會損害肺內(nèi)氣囊的內(nèi)層,即肺泡上皮,從而阻止氧氣從肺部傳遞到血液,并可能導(dǎo)致死亡。發(fā)展為ARDS的COVID-19患者會成為危重病人。到目前為止,還沒有開發(fā)出專門針對COVID-19患者ARDS的藥物。了解哪些基因靶點和信號通路參與了上皮組織再生是有效治療ARDS等類似疾病的關(guān)鍵。
之前的研究表明,II型肺泡肺細(xì)胞(type II alveolar pneumocytes, AT2)是參與肺組織修復(fù)的重要細(xì)胞。它們通過自我更新和轉(zhuǎn)分化為I型肺泡肺細(xì)胞(AT1),促進(jìn)肺氣囊與附近毛細(xì)血管之間的氣體交換。然而在本研究之前,尚不清楚AT2細(xì)胞在發(fā)生疾病相關(guān)損傷后基因的可及性發(fā)生了哪些變化,以促進(jìn)組織修復(fù);以及再生AT2細(xì)胞是如何影響與附近間充質(zhì)細(xì)胞的相互作用的。這一相互作用在組織修復(fù)中也很重要。
圖片來源:Pixabay
通過全基因組分析,研究小組評估了肺損傷后AT2細(xì)胞發(fā)生的變化。這些變化包括打開細(xì)胞內(nèi)的染色體,并使特定的基因可被細(xì)胞轉(zhuǎn)錄機器接近。之后,研究人員對AT2細(xì)胞和間充質(zhì)細(xì)胞進(jìn)行單細(xì)胞分析,以更好地理解這兩種細(xì)胞類型在損傷過程中是如何相互作用的,以及參與了哪些細(xì)胞信號通路。這兩種方法匯合在同一條信號通路上,其中被稱為STAT3的轉(zhuǎn)錄因子增加了腦源性神經(jīng)營養(yǎng)因子(brain-derived neurotrophic factor, BDNF)的表達(dá),進(jìn)而促進(jìn)了肺組織的再生。
圖片來源:CC0 Public Domain
在進(jìn)一步分析這一通路時,研究人員發(fā)現(xiàn)了一種自然產(chǎn)生的化合物,稱為7,8-二氫黃酮(7,8-Dihydroflavone, 7,8-DHF)。它針對該通路中的某種受體,刺激并加速了多個小鼠肺損傷模型中的肺組織修復(fù)。
該研究的第一作者、醫(yī)學(xué)博士、賓夕法尼亞大學(xué)佩雷爾曼醫(yī)學(xué)院醫(yī)學(xué)講師和肺部專家的Andrew J.Paris說:“我們相信這些發(fā)現(xiàn)可以促進(jìn)開發(fā)一種新的治療方案,從而幫助患者從COVID-19及類似疾病中恢復(fù)?;谠撗芯康慕Y(jié)果,我們認(rèn)為7,8-DHF是進(jìn)入臨床試驗治療肺部疾病患者的優(yōu)秀候選者。”
翻譯:胡舒昶
審校:巢栩嘉
引進(jìn)來源:費城兒童醫(yī)院
引進(jìn)鏈接:https://medicalxpress.com/news/2020-09-druggable-pathway-lung-tissue.html
文章來源:環(huán)球科學(xué)





